
リチウムイオン電池の充電速度を制限するものは何ですか?
最終的な分析では、それはまだ材料と技術です。リチウムイオン電池を完全に充電するプロセスは、リチウムイオンが正極と負極の間を移動し、電子を運び、放出することにより、リチウム電池の充電および放電機能を実現することです。これには一定の反応時間が必要です。充電が速すぎると、リチウム電池の異常な反応が発生して結晶化が発生し、充電中に充電速度が電池の許容範囲を超えると、リチウム電池の内部抵抗が増加し、電池が危険なほど過熱します。
バッテリー業界では、通常、充電速度と電流の関係を説明するために充放電率が使用されます。バッテリーが1時間で完全に充電される速度は1Cと呼ばれ、30分しかかからない速度は2Cと呼ばれ、1Cを超える速度は急速充電と呼ぶことができます。現在、リチウムイオン電池の充電速度は一般的に1C〜3Cに達する可能性があり、一部のバッテリーは5Cに達することさえあります。しかし、10Cの放電率と比較すると、それでもはるかに悪いです。
最大充電率のボトルネックに加えて、異なるSOC(State of Charge)の下でバッテリーが耐えられる充電速度も異なります。一般に、充電速度は低速-高速-低速の法則に従い、SOCが90%を超えると、バッテリーの内部抵抗が大幅に増加し、充電速度が遅くなります。
したがって、電気自動車のユーザーであり、充電にできるだけ時間を節約したい場合は、10%未満の電力を使用しないようにしてください。また、充電時に完全に充電する必要はありません。次の旅行のマイルをカバーできる90%以上または十分な電力。
バッテリー自体のボトルネックに加えて、周辺機器の充電デバイスにも独自の制限があります。
理論的には、電流を増やすことで充電速度を上げることができます。ただし、電流が大きすぎると、バッテリー内のリチウムイオンの拡散速度が電子の拡散速度に追いつかず、電子イオンの動作が同期しなくなり、バッテリーの性能に影響を及ぼし、それに応じて達成可能な充電容量が減少し、火災や爆発の危険さえあります。したがって、急いでいない場合は、バッテリーの寿命を延ばすのに役立つ低速充電を使用することをお勧めします。また、リチウム電池も安全です。充電中、リチウム電池内のリチウムイオンの拡散速度は、温度、カソード材料、および構造と密接に関連しています。
まず、温度が高いほど拡散速度が速くなります。しかし、温度が高すぎるとバッテリーの寿命が短くなったり、充電の安全性が下がったりするなどの問題にもつながります。温度が低すぎると、バッテリーに金属リチウムが堆積し、バッテリー、特にLiFePO4バッテリーの内部短絡が発生します。一般に、一般的なLiFePO4バッテリーの容量は、0°Cで約60〜70%、-20°Cでわずか20〜40%です。 したがって、寒い北の冬には、電気自動車はバッテリーモジュールを加熱する機能を持たなければならず、消費電力は明らかに速くなります。
2つ目は素材です。異なる材料の拡散率は大きく異なります。LiCoO2、LiMn2O4、LiFePO4、NCM、NCAなどはすべて優れた性能を持つカソード材料です。
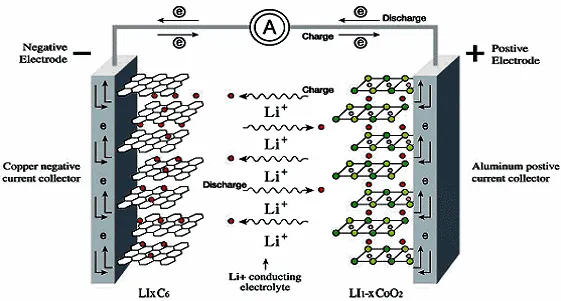
リチウムイオン電池の基本動作原理と構造
基本原理:正極は還元反応を起こして電子を獲得します。負極は酸化反応を起こし、電子を失います。電子は負荷を通過して負極から正極に流れ、正極から負極に向かう方向に電流を形成します。
1 (+1)原子価リチウムイオン <—— (1-x) (+1/(1-x))原子価リチウムイオン + x (+1)原子価リチウムイオン + x電子。
x = 0.5と仮定すると、次のようになります。
1 (+1)原子価リチウムイオン <——0.5 (+2)原子価リチウムイオン + 0.5 (+1)原子価リチウムイオン + 0.5電子。
両側に 2 を掛けると、次のようになります。
2 (+1)原子価リチウムイオン <——1 (+2)原子価リチウムイオン + 1 (+1)原子価リチウムイオン + 1電子。
取得の簡素化:
1(+1)価数リチウムイオン<——1(+2)価数リチウムイオン+ 1電子。
この式は、実際には個々の反応ではなく、全体的な反応を表しています。
負極のリチウム原子は電子を失い、(+1)原子価リチウムイオンに酸化されます。電子は負極から負荷回路に流れ込み、リチウムイオンは電解質を介して正極に流れます。
正極のコアは(+1 /(1-x))原子価リチウムイオンであり、負極のコアはリチウム原子であり、2つが反応して(+1)原子価リチウム原子を生成し、酸化還元反応の電子の流れが電流を形成します。
リチウム電池製造のプロセスでは、商品が常に棚を必要とするのと同じように、正極のリチウムイオンと負極のリチウム原子を運ぶために物質が常に必要であり、リチウムイオンの棚はリン酸塩イオンであり、リチウムイオンとともに正極を形成します。負極のリチウム原子は多孔質グラファイトなどの材料で構成されているため、反応後に負極が減少したり、消失したりすることはありません。正極と負極の間には電解質とセパレータがあり、リチウムイオンの流れだけでなく、正極と負極を分離して内部短絡を防ぐためにも使用されます。

リチウムイオン電池の特性
ユーザーが最も気にしているリチウムイオン電池の特性は、リチウムイオン電池が通常の動作条件下で解放できる充電回数を指す2000mAhなどの容量です。
リチウムイオン電池の仕様書を見てみましょう。このバッテリーのより重要なパラメータは次のとおりです。
容量:2000 mAh
充電カットオフ電圧:4.2V
放電カットオフ電圧:2.5V
最大充電電流:4000 mA
最大放電電流:20000mA
要するに、それはすべてバッテリー容量と充電と放電に関するものです。バッテリー容量は、負極が放出できる電子の数と、正極が受け取ることができる電子の数によって異なります。
なぜ充電カットオフ電圧があるのですか?
言い換えれば、過電圧充電の結果はどうなるのでしょうか?負極はグラファイト原子とリチウム原子で構成されています。実はリチウムは原子の形では存在せず、リチウムイオンの形でグラファイトと共存しています。過電圧充電後、リチウムイオンは結晶性リチウムに沈殿し、結晶性リチウムは充電と放電に参加できなくなり、バッテリー容量が減少します。
放電カットオフ電圧があるのはなぜですか?
言い換えれば、過電圧放電の結果はどうなるのでしょうか?過放電後、負極のリチウムイオンが多量に正極に流れ込み、グラファイトが空になり、一部の領域が崩壊します。折りたたまれた領域はリチウムイオンを貯蔵できなくなり、バッテリー容量も減少します。
私たちとリチウム電池作りについて話し合うことを歓迎します、私たちのメールは sales08@sztaipu.com です。






